当医院或采购官搜索供应商信息时,他们并不想看长篇“公司介绍”,而是需要可核验的答案:是否510(k)已公开、PMA补充是否最新、UDI与标签是否一致、产品代码是否匹配、样机与招标材料如何准备。这些看似零碎的问题,其实可以被组织成一张“问句→采购意图→证据来源→安全措辞”的地图。
本文基于美国市场术语与流程,整理“医疗器械出口 常见问题”的高频长尾问句,按三类采购意图分簇:资格核验、技术比对、商务谈判。每个问题簇都配有语音/口语化变体与中英合规措辞模板,便于直接用于网站FAQ、招标附件与销售答疑。
轻量提示:需要一份可复制的中英“安全措辞模板”与“问句聚合页”示例?可查看我们的知识库能力介绍与示例资源:知识库可追溯引用与聚合页工作流。
方法与来源说明
数据来源与时间窗:优先使用FDA与eCFR官方页面,辅以Federal Register;本文链接均为截至2026-02-05的可访问官方入口,并在关键处保留“证据链接占位”以便更新。
合规与审校:所有声明以官方文本为准;避免超出“适用范围/预期用途”的表述;在模板中保留时间窗与编号位。
透明披露:QuickCreator 是我们的产品。我们以与本文中引用的其他权威来源一致的标准提供说明,并在适当位置给出站内延伸阅读链接(不构成宣传)。关于知识库能力,可参考:知识库可追溯引用。
US术语与缩写速查表
下表覆盖“医疗器械出口 常见问题”在美国语境下常见主题、对应法规/指南与示例安全表述(便于在答复或招标材料中快速引用)。
主题 | 对应法规/指南 | 常见缩写 | 示例安全表述 | 证据链接占位 |
|---|---|---|---|---|
标签与UDI | 21 CFR Part 801 子部分B(UDI) | UDI、DI、PI | 本产品标签包含唯一器械标识符(UDI)的设备标识符(DI)部分;生产标识符(PI)以供方可审计材料为准。 | eCFR Part 801;FDA UDI 概览 |
510(k) | FD&C Act 510(k) | 510(k), SE | 可在FDA 510(k)公开记录核对“实质等同(SE)”决定与摘要。 | 510(k)数据库入口 |
PMA | Premarket Approval | PMA, Supplement | PMA详情页含批准函、标签与补充(Sxxx)列表,以最新补充为准。 | PMA数据库入口 |
De Novo | De Novo Classification | DEN | De Novo订单PDF详述分类依据与专控要求。 | De Novo数据库入口 |
产品分类 | Product Classification | Product Code, Reg. No. | 通过Product Code可定位对应21 CFR Regulation Number与Class。 | 产品分类数据库入口 |
注册与列名 | Registration & Listing | FEI, O/O | 可下载公开注册与列名文件核验机构与器械列名状态。 | R&L下载与说明页 |
不良事件 | MAUDE | MDR | 可按产品代码/制造商检索不良事件报告并导出。 | MAUDE入口 |
召回 | Enforcement Reports | Class I/II/III | 可按产品/公司筛选召回记录与状态。 | 召回搜索入口 |
进口警报 | Import Alerts | DWPE | “红名单”项可触发无物检扣留(DWPE)。 | Import Alerts 主页 |
质量体系 | QMSR 对齐 ISO 13485 | QMSR | QMSR自2024年发布,实施安排以官方页面为准。 | FR最终规则;FDA QMSR页 |
权威入口示例:
eCFR Part 801 标签与UDI(官方):21 CFR Part 801 当前文本
FDA 510(k)数据库(官方):按编号/产品代码检索510(k)
FDA PMA数据库(官方):查询PMA与补充及标签文件
De Novo数据库(官方):查询De Novo订单PDF
产品分类数据库(官方):查Product Code与Regulation Number
R&L 文件下载与说明(官方):下载公开注册与列名文件|了解注册与列名流程
AccessGUDID 与 UDI(官方):AccessGUDID 检索DI|UDI 系统概览
MAUDE 与召回(官方):MAUDE 不良事件|召回搜索
Import Alerts(官方):FDA进口警报目录
QMSR(官方):Federal Register 最终规则 2024|FDA QMSR 概览
语音搜索与口语化表达范式
EN:Is this device 510(k) cleared? What’s the K number?
EN:Show me the UDI record in GUDID for [device name].
EN:What’s the FDA product code and regulation number for [device]?
EN:Any MAUDE reports or recalls on [brand/model]?
EN:Is this under PMA? Where can I download labeling?
CN:这款设备有510(k)吗,编号是多少?
CN:有没有GUDID的UDI记录链接?
CN:它的产品代码和法规编号是什么?
CN:有没有不良事件或召回记录?
CN:是否PMA批准,哪里能下载标签?
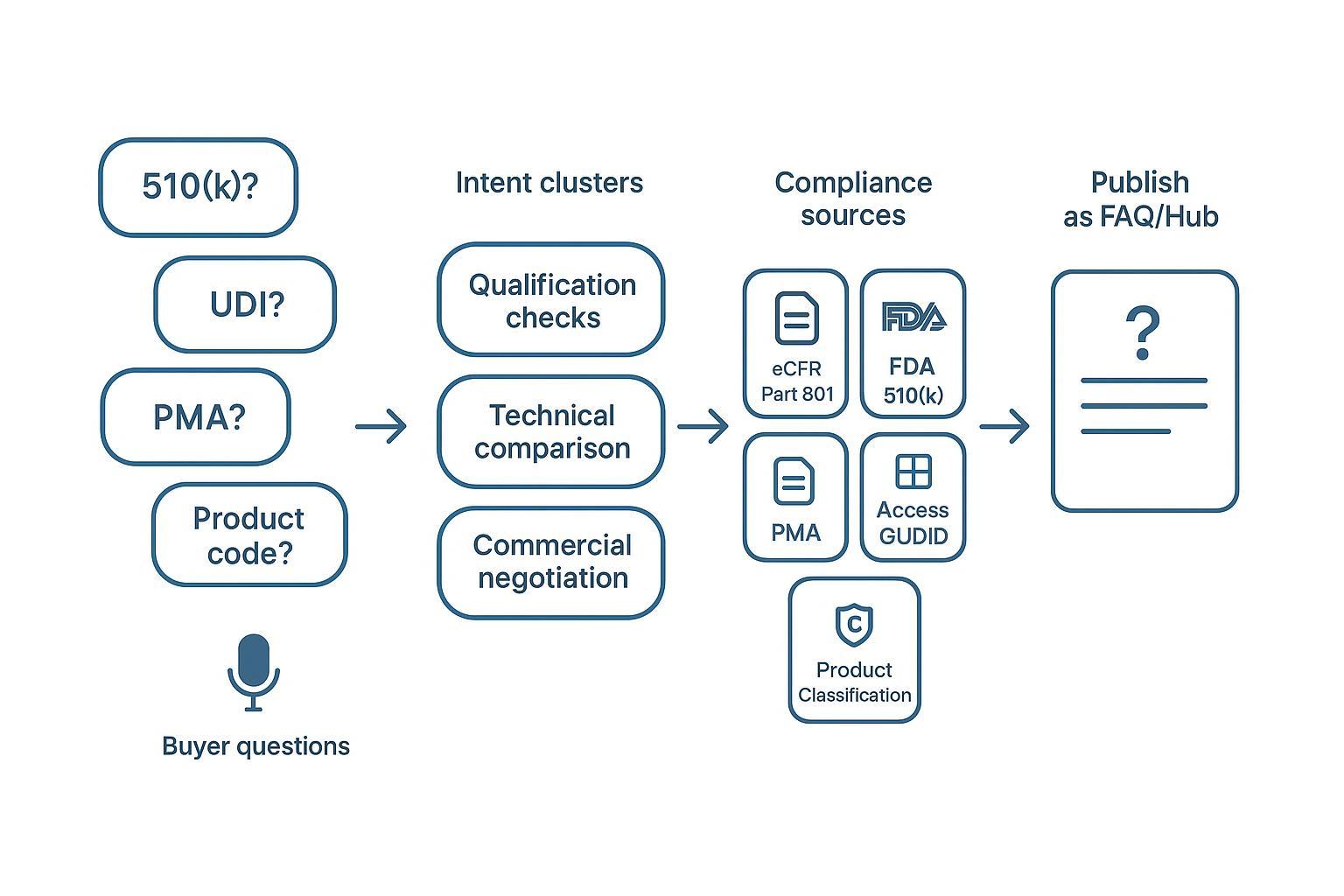
问句簇清单与安全措辞模板
说明:以下按“资格核验→技术比对→商务谈判”三层意图组织。每项含语音/口语化变体与中英可复用、安全且中性的措辞模板。为避免冗长,证据位仅列权威入口,答复时请填入具体编号与时间窗。
资格核验类|核实510(k)状态与编号
语音变体:Is it 510(k) cleared? What’s the K number?|这款设备的510(k)编号是多少?
安全措辞(中):依据FDA 510(k)公开记录,本产品在[日期]显示为“实质等同(SE)”,编号为[Kxxxxx](以官方页面为准)。
Safe wording (EN): According to the FDA’s 510(k) public record, this product shows a “substantial equivalence (SE)” decision as of [date], under K-number [Kxxxxx] (subject to the official page).
Do:引用官方摘要中的中性技术描述;保留日期与编号。
Don’t:避免“最安全/最佳”等绝对化词。
证据:FDA 510(k)数据库入口(见上方权威入口)。
资格核验类|PMA批准与补充文件核查
语音变体:Is this under PMA? Can I download labeling?|是否PMA批准,可否提供标签?
安全措辞(中):PMA详情页包含批准函、标签与补充(Sxxx)清单;请以最新补充为准进行技术核对。
Safe wording (EN): The PMA detail page provides approval letters, labeling, and supplements. Please verify technical information against the latest supplements.
Do:用“以最新补充为准”限定;保留PMA号与下载日期。
Don’t:避免据此推导临床效果优越性。
证据:FDA PMA数据库入口。
资格核验类|De Novo分类确认
语音变体:Is it a De Novo device? What’s the DEN number?|是否De Novo,编号是多少?
安全措辞(中):De Novo订单PDF载明分类依据与专控要求;通常归类至Class II(以订单为准)。
Safe wording (EN): The De Novo order PDF outlines classification rationale and special controls; classification is typically to Class II (subject to the order).
Do:引用订单PDF标题、发布日期与链接。
Don’t:避免超出PDF列示的适用范围。
证据:De Novo数据库入口。
想把前三类问句快速整理成“问答聚合页”并批量添加证据位?可参考:知识库可追溯引用与聚合页工作流。
资格核验类|产品代码与法规编号定位
语音变体:What’s the product code and regulation number?|产品代码与法规编号是什么?
安全措辞(中):通过产品分类数据库可定位Product Code与对应Regulation Number、Class与Review Panel信息。
Safe wording (EN): Use the Product Classification database to identify the product code, corresponding regulation number, class, and review panel.
Do:粘贴产品代码与Regulation Number;
Don’t:不要用近似中文翻译代替英文官方术语。
证据:产品分类数据库。
资格核验类|注册与列名交叉核验
语音变体:Is the establishment registered and devices listed?|企业是否注册并完成列名?
安全措辞(中):可通过公开下载文件核验机构注册与器械列名状态;以文件时间窗为准。
Safe wording (EN): Verify establishment registration and device listing via the publicly downloadable files; use the file’s date window.
证据:R&L下载与说明页。
资格核验类|UDI与AccessGUDID匹配
语音变体:Show me the UDI record in GUDID.|能提供GUDID的UDI记录吗?
安全措辞(中):GUDID中的设备标识符(DI)与标签一致;生产标识符(PI)信息以供方可审计材料为准。
Safe wording (EN): The DI in GUDID matches the labeling. Any PI details should rely on auditable supplier materials.
证据:AccessGUDID入口与UDI概览。
技术比对类|中性呈现适用范围与关键规格
语音变体:What’s the intended use and key specs?|适用范围与关键规格是什么?
安全措辞(中):引用510(k)摘要或PMA标签中的中性技术描述与适用范围,避免超出官方文本。
Safe wording (EN): Cite neutral technical descriptions and intended use from the 510(k) summary or PMA labeling.
证据:510(k)/PMA入口。
技术比对类|不良事件与召回记录佐证
语音变体:Any MAUDE reports or recalls?|有无不良事件或召回?
安全措辞(中):请参考FDA公开数据库的不良事件与召回记录,并结合事件严重性与纠正措施进行解读。
Safe wording (EN): Refer to the FDA public databases for adverse events and recalls; interpret results considering severity and corrective actions.
证据:MAUDE与召回搜索入口。
技术比对类|QMSR对供应商尽调的影响
语音变体:Is the supplier aligned with QMSR?|供应商是否与QMSR对齐?
安全措辞(中):QMSR与ISO 13485对齐的实施安排以官方页面为准;建议在尽调时标注适用时间窗。
Safe wording (EN): QMSR alignment and implementation should follow the official pages; note the applicable date window in due diligence.
证据:Federal Register 最终规则与FDA QMSR概览。
技术比对类|软件器械与网络安全参考
语音变体:Any FDA premarket cybersecurity guidance applicable?|上市前网络安全有哪些要求?
安全措辞(中):参考FDA 2023版上市前网络安全指南与SaMD/CDS官方页面,按其列出的内容准备材料。
Safe wording (EN): Use the FDA premarket cybersecurity guidance and SaMD/CDS pages to prepare materials as outlined.
证据:网络安全指南与SaMD/CDS官方页面。
商务谈判类|样机评估与临床验证文件包
语音变体:Do you support evaluation units and what files are included?|是否支持样机评估,需要哪些文件?
安全措辞(中):可提供510(k)/PMA编号、AccessGUDID截图与IFU摘要页;样机用于技术评估,非临床治疗用途(如适用)。
Safe wording (EN): Provide the 510(k)/PMA number, an AccessGUDID screenshot, and an IFU summary page; evaluation units are for technical assessment, not for clinical use (where applicable).
证据:510(k)/PMA/AccessGUDID入口。
商务谈判类|交付周期与SLA的合规表述
语音变体:What’s the delivery timeline and SLA?|交付周期与SLA如何表述?
安全措辞(中):交付与服务级别为预估范围,具体以合同与招标条款为准;本说明不构成保证或担保。
Safe wording (EN): Delivery and service levels are estimates and subject to contract/tender terms. This statement does not constitute a guarantee or warranty.
商务谈判类|招标资质与证据材料摆放
语音变体:How should we organize regulatory evidence for tenders?|招标材料如何摆放监管证据?
安全措辞(中):建议附“监管编号清单(510(k)/PMA/DI)+ 截图与下载时间戳”,并统一命名规范便于审计。
Safe wording (EN): Attach a list of regulatory identifiers (510(k)/PMA/DI) with screenshots and timestamps, and use a consistent naming convention for audit.
合规措辞模板精选(中英可直接复用)
510(k)资格核验
CN:依据FDA 510(k)公开记录,本产品在[日期]显示为“实质等同(SE)”,编号为[Kxxxxx](以官方页面为准)。
EN:According to the FDA’s 510(k) public record, this product shows a “substantial equivalence (SE)” decision as of [date], under K-number [Kxxxxx] (subject to the official page).
UDI与GUDID匹配
CN:GUDID显示的设备标识符(DI)与标签一致;如需生产标识符(PI)信息,请以供方提供的可审计材料为准。
EN:The DI in GUDID matches the labeling. For any PI details, please rely on auditable materials provided by the supplier.
PMA与标签
CN:PMA详情页提供批准函、标签与补充清单;技术核对请以最新补充为准。
EN:The PMA detail page provides approval letters, labeling, and supplements. Please verify technical information against the latest supplements.
商务条款
CN:交付与服务级别为预估范围,具体以合同与招标条款为准;本说明不构成保证或担保。
EN:Delivery and service levels are estimates and subject to contract/tender terms. This statement does not constitute a guarantee or warranty.
FAQ 加问区
是否支持样机评估与临床验证,合规需哪些文件?
建议提供:510(k)/PMA编号、AccessGUDID截图、IFU摘要页,并保留时间戳与下载路径说明。
如何核实510(k)/PMA状态与产品代码?
步骤:510(k)/PMA数据库检索编号 → 产品分类数据库确认Product Code与Regulation Number → 访问AccessGUDID核对设备名称与DI。
UDI、标签与IFU对采购的关键点?
要点:UDI仅含DI;标签与IFU应与公开记录一致;如涉及MRI安全状态等,请引用官方原文。
价格与招标能否提供长单折扣与售后SLA?
建议:采用“示例指标+条件限定+不构成保证”表述,并以合同为准。
Next steps 与资源
如果你希望将本文的“医疗器械出口 常见问题”快速整理成可审计的FAQ与聚合页,并在卡片中自动携带“证据链接占位”:可查看示例工作流与能力说明:知识库可追溯引用与聚合页工作流。
需要把模板下载、表单与订阅等转化组件嵌入FAQ/聚合页,收集合规询盘?参考:营销组件与表单示例。
—
更新与版本:本文链接与模板建议最后核验于 2026-02-05;请以官方页面的最新文本和日期为准。
Ready to Transform Your Content?
Join thousands of content creators using QuickCreator to produce high-quality content faster. Start your 14-day free trial today.
Start Free Trial